2023年已过一半,数据显示,上半年国内首次获批上市65款新药(含改良新,不包括新适应症获批)。2023年下半年NMPA又将批准多少款新药?
以下,综合当前上市申请中的新药项目和平均审评时长,展望下半年潜在有望获批的创新药。
本文将选出其中10款与读者们分享,以下排名不分先后。
01
礼来:替尔泊肽
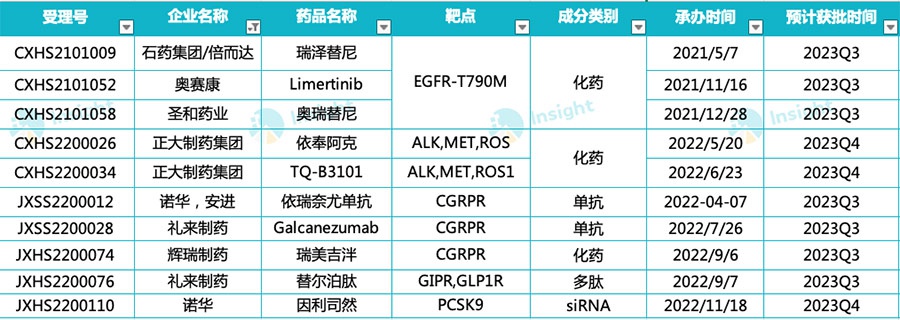
2022年9月,礼来制药的GLP-1R/GIPR双重激动剂「替尔泊肽注射液」2型糖尿病适应症在国内申报上市(受理号:JXHS2200075/6/7/8)。

替尔泊肽最早于2022年5月在美国获批糖尿病适应症,到2023年Q1上市未满一年,已经斩获5.685亿美元的单季度销售额。据礼来此前提供的替尔泊肽相较于已上市两大GLP-1类药物度拉糖肽和司美格鲁肽的处方增长趋势,可以看出其放量速度是远超的。
仅仅2型糖尿病单独适应症就有如此威力,在肥胖症、OSA、NASH等代谢领域适应症连番登场之后,替尔泊肽的未来潜力显然是不可限量的。
单从肥胖症来看,今年4月,礼来宣布基于其肥胖症III期临床的积极结果,即将完成在美国地区上市申请的滚动递交。在针对肥胖症适应症的 SURMOUNT-02 III期研究结果显示,15mg高剂量替尔泊肽在72周实现15.7%的减重效果,即在基线 100.7kg的体重下减重15.6kg。
而在国内,礼来也在积极推进减肥适应症进展。今年2月,礼来宣布替尔泊肽(Tirzepatide)在中国肥胖或超重成人中开展的III期试验SURMOUNT-CN达到主要终点和所有关键性次要终点。
02
诺华:长效 RNAi 降脂药
2022年11月,诺华Inclisiran注射液在国内申报上市(受理号:JXHS2200110),有望于今年下半年获批。
Inclisiran(研发代号:KJX839)是诺华以97亿美元收购TMC获得的一种靶向PCSK9长效RNAi降脂药,每年仅需皮下注射给药两次即可有效地降低血液循环中低密度脂蛋白LDL-C的水平,达到降低血脂的效果。
相较于目前上市的PCSK9靶向抗体药和他汀类降脂药每两周一次或每月一次的给药频率,Inclisiran在患者依从性方面有着独一无二的治疗优势。
此前诺华披露的ORION系列研究显示,对于使用最大耐受剂量的LDL-C降低疗法后LDL-C水平仍高于目标值的患者。与安慰剂组相比,接受Inclisiran治疗的患者LDL-C从基线至第510天的平均降幅可达50%~52% 。
ORION-10、ORION-11 研究结果
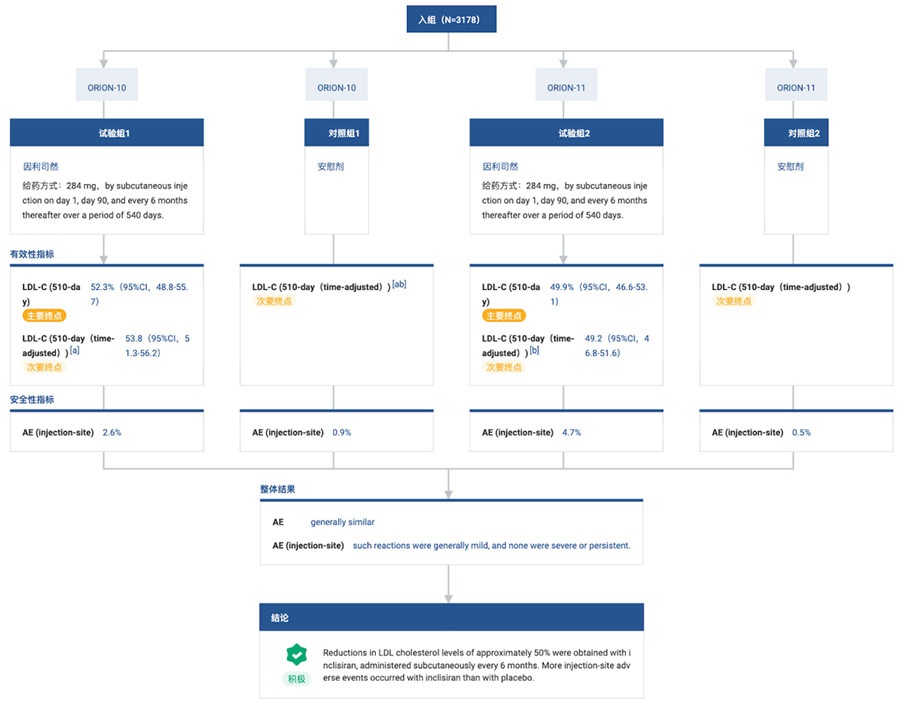
而对于伴随脑血管疾病(CeVD)和多血管疾病(PVD)ASCVD患者,诺华在2021年9月公布的ORION-9、ORION-10和ORION-11研究试验的两项汇总事后分析的结果也表明,每年接受两次Inclisiran治疗,可有效且持续地降低ASCVD亚组患者(CeVD、PVD)的LDL-C水平。
在2022AHA年会上,诺华还公布了为期4年的II期开放标签ORION-3扩展试验结果:Inclisiran可在4年内持续有效降低ASCVD或ASCVD等危症患者的LDL-C水平。这些患者之前在接受最大耐受他汀类药物治疗后,LDL-C仍然升高。
在安全性方面,治疗4年后,Inclisiran耐受性良好,安全性特征与既往18个月的 III 期研究LDL-C降低一致。最常见的药物相关治疗后出现的不良事件为全身性疾病及注射部位各种反应,大多数为轻度至中度。
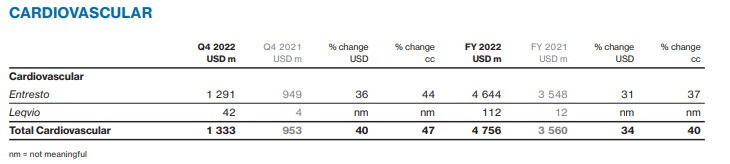
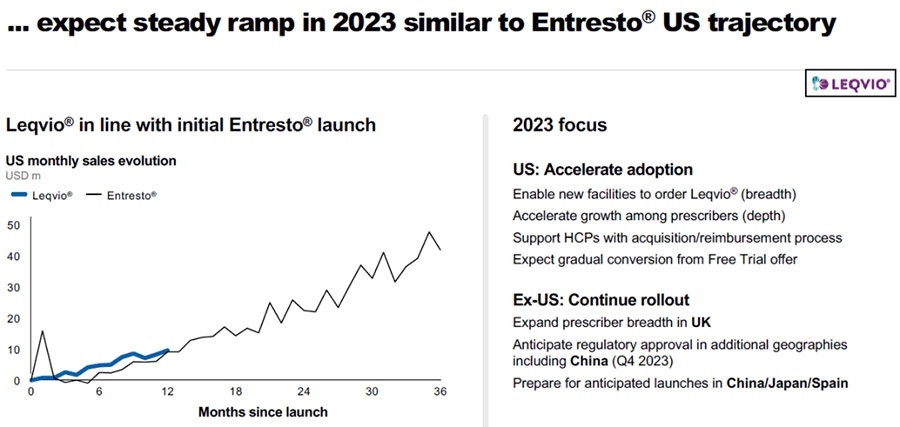
据诺华财报,凭借优异的临床优势,刚于2021年底获FDA批准上市的Inclisiran(Leqvio)2022Q1销售额已超过2021年全年,且2022年全年销售额已达1.12亿美元。
来自:诺华财报
从放量速度来看,据诺华评估,Inclisiran与沙库巴曲+缬沙坦(Entresto)放量速度基本一致,而后者2022全年销售额已达46.44亿美元,有望成为诺华的下一个核心增长点,市场潜力无限。
来自:诺华财报
03
正大天晴:2款ALK抑制剂
正大天晴在2022年申报上市的2款ALK抑制剂也离获批节点不远了。
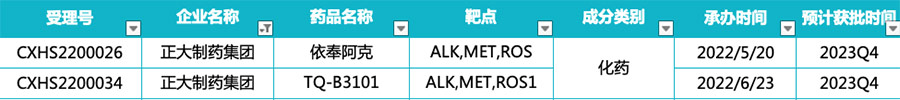
正大天晴布局的TQ-B3101和依奉阿克(TQ-B3139)均为ALK/MET/ROS1抑制剂 ,分别针对ROS1阳性和ALK阳性NSCLC推进上市审评进程,预计2023年Q4获批。
此前正大天晴曾披露TQ-B3101一线治疗ROS1阳性NSCLC的II期临床数据(登记号:NCT03972189),结果显示,独立评审委员会(IRC)评估的ORR为78.4%(95%CI,69.6-85.6),mPFS为15.6个月(95%CI,10.2-27.0)。
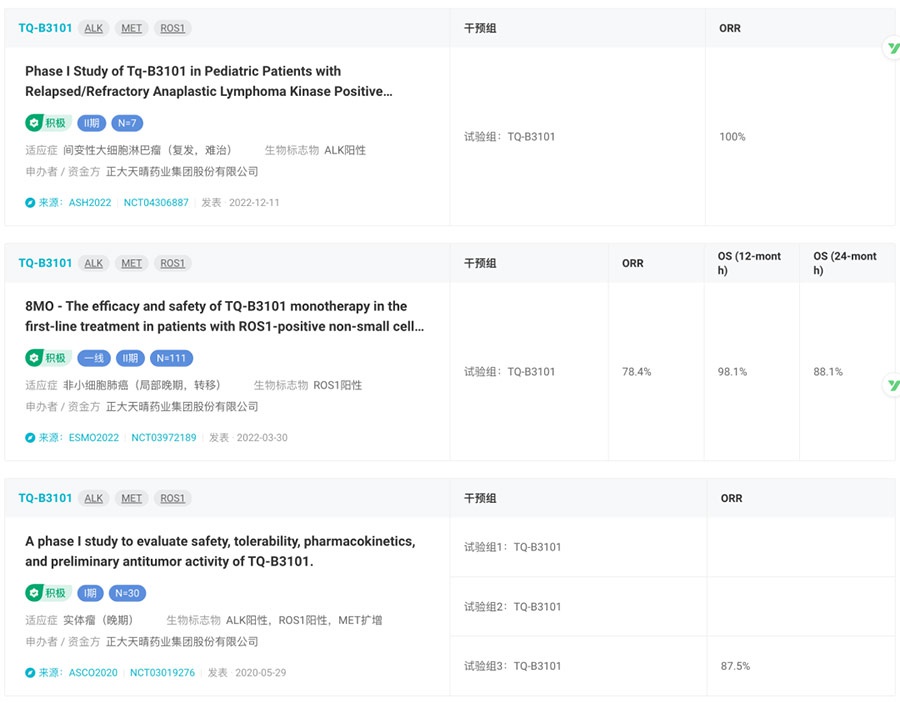
TQ-B3101 试验结果
TQ-B3139 是正大天晴与首药控股联合开发的,由首药控股负责化合物分子的设计与优化,经过验证的临床前候选化合物转交天晴进行临床阶段开发,双方共同享有知识产权。
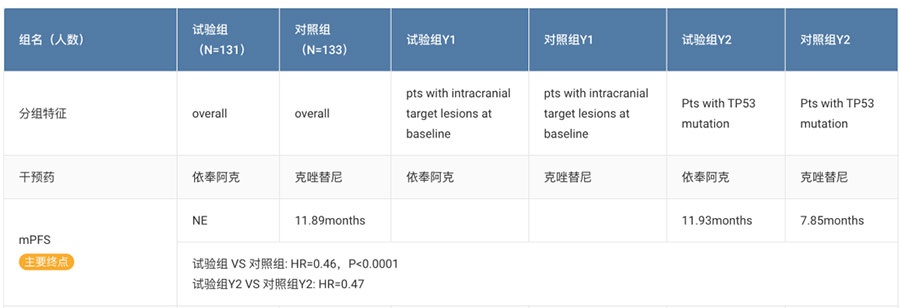
2022ESMO会上曾披露依奉阿克对比克唑替尼一线治疗ALK阳性晚期NSCLC的III 期临床TQ-B3139-III-01试验数据。该研究的主要终点是独立审查委员会(IRC)评估的无进展生存期(PFS)。
结果显示,依奉阿克组mPFS(IRC评估)显著优于克唑替尼(NRvs11.89m;HR=0.46,p<0.0001),合并TP53突变的患者同样可以从依奉阿克治疗中获益(mPFS:11.93mvs7.85m,HR=0.47)。IRC评估的ORR为81.68% vs69.92%,同时依奉阿克组具有更持久的疗效(mDoR:NRvs12.68m,p=0.0014)。
NCT04009317试验结果
04
三代EGFR-TKIs:瑞泽替尼、Limertinib、奥瑞替尼
在第一梯队三代EGFR-TKIs奥希替尼、阿美替尼和伏美替尼之后,国内第二梯队的4家在2021年度相继报上市,而在今年5月贝达药业贝福替尼也已获批上市,其余三款预计将在今年下半年获批。

石药集团/倍而达药业 · 瑞泽替尼
甲磺酸瑞泽替尼(BPI-7711)是一款不可逆、高选择性的第三代小分子EGFR-TKI,对EGFR敏感突变及EGFR T790M耐药突变具有显著的抑制活性。研究表明,BPI-7711在体外细胞实验中对EGFR(T790M/L858R、外显子 19 缺失) 基因突变的非小细胞肺癌表现出明显的抗肿瘤活性,且有效抑制浓度(EC50)比EGFR 基因野生型的抑制浓度低35倍以上,体现了较好的安全性。
2021年3月,石药集团与倍而达药业订立产品授权及商业化协议,获得BPI-7711在中华人民共和国(包括香港特别行政区和澳门特别行政区,但不包括台湾地区)的商业化授权。2021年5月,倍而达药业向NMPA递交了新药上市申请。数据显示,5月23日该项上市申请已经离开补充资料任务。
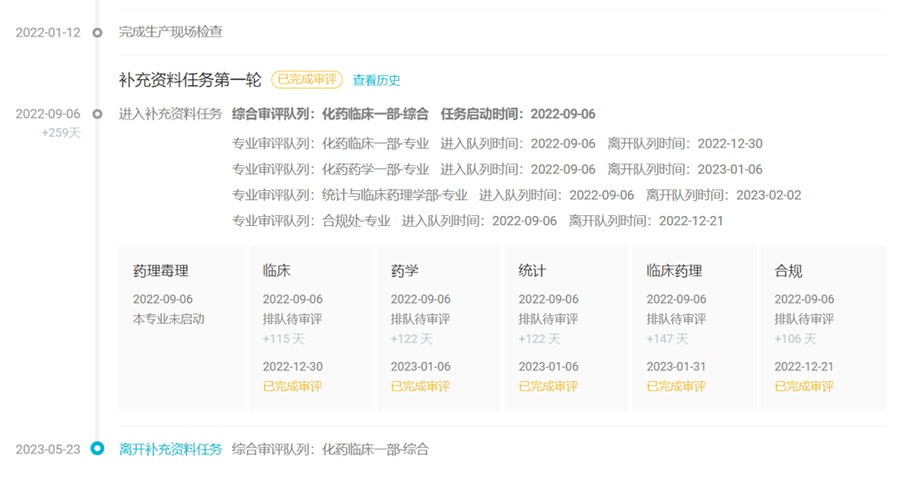
上市申报时光轴(局部)
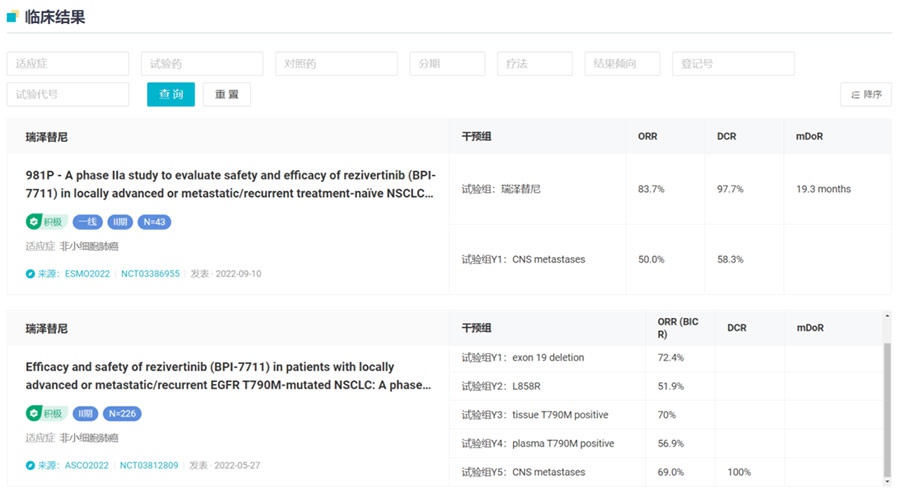
2022年ASCO大会上公布了瑞泽替尼的IIb期临床试验数据。结果显示,BICR评估的ORR为64.6%(95%CI,58.0-70.8),DCR为89.8%(95%CI,85.1-93.4),脑转移患者(N=91)的ORR为69.0%(95%CI,49.2-84.7)。除此之外,瑞泽替尼作为一线疗法的II期临床结果也已经公布,详见下图。
瑞泽替尼临床试验结果
奥赛康药业 · Limertinib
ASK120067(Limertinib)是奥赛康药业与上海药物所、广州健康院合作开发的高选择性、不可逆第三代EGFR-TKI,用于既往EGFR-TKI治疗时或治疗后出现疾病进展、并且经检测确认存在EGFR-T790M突变阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的治疗。
数据显示,ASK120067最早于2017年获得临床批件,2018年启动临床试验。2021年11月16日,其上市申请获CDE受理。目前正在第一轮补充队列中。
上市申报时光轴(局部)
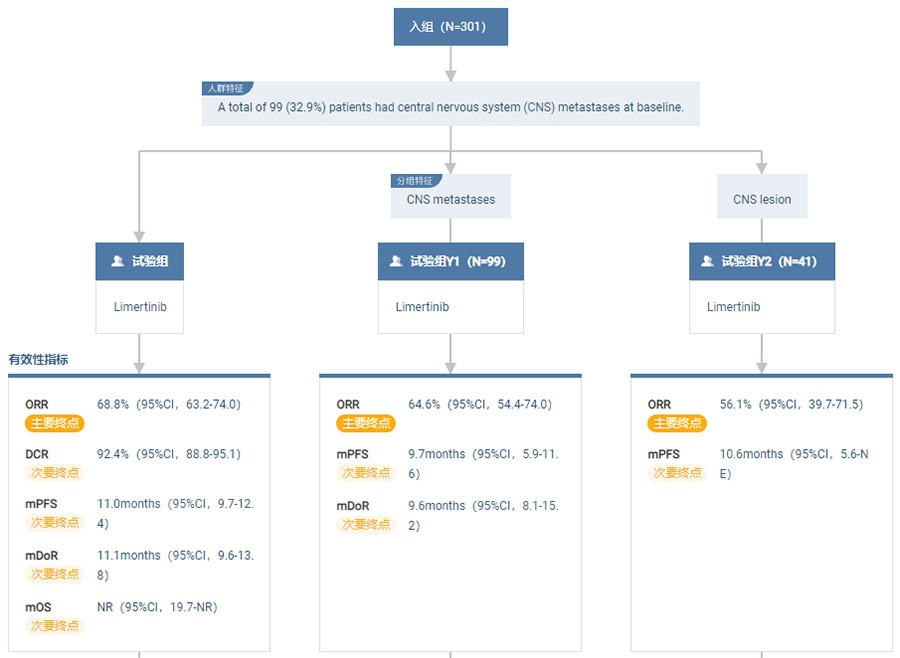
2022ASCO数据显示,ASK-LC-120067-I/II-IIb关键临床研究共计入组301例受试者,患者临床获益明显。经第三方独立影像评估(IRC)的客观缓解率(ORR)为 68.8%(95%CI,63.2-74.0);IRC评估的中位无进展生存期(PFS)为11.0个为(95%CI,9.7-12.4)。
同时,脑转移患者也有明显获益,基线有脑转移的受试者IRC评估的ORR为64.6%(95%CI,54.4-74.0),mPFS为9.7个月(95%CI,5.9-11.6)
ASK120067片主要不良反应为EGFR靶点常见不良反应,患者耐受性较好。
与其他三代EGFR-TKI一样,ASK120067也同样布局了一线适应症,于2019年8月公示启动了相应III期临床(CTR20191523)。
05
偏头痛:CGRP 靶点 3 位重点参与者开启中国上市进程
针对CGRP拮抗剂,此前国内尚未有获批上市的,但自2022年开始,该类药物在国内开始密集上市申报,从诺华的Erenumab,到礼来的Galcanezumab,再到辉瑞的 Rimegepant(瑞美吉泮),今年这3款产品均有望获批。
诺华/安进 · 依瑞奈尤单抗
2022年4月,诺华与安进合作开发的偏头痛新药依瑞奈尤单抗/Erenumab在国内提交上市申请并获受理(受理号:JXSS2200012)这也是国内首款申报上市的抗CGRPR单抗。
Erenumab(AMG334)最早由安进开发,是一种全人源 IgG2 单抗,通过结合并拮抗CGRP受体功能来治疗偏头痛。2015年8月,诺华与安进达成合作,共同开发阿尔茨海默病和偏头痛领域新药,其中就包括了Erenumab;2017年4月,两家公司扩大了针对Erenumab的全球合作,共同在美国开发Erenumab,安进保留在日本的独家商业化权利,而诺华则在世界其他地区商业化该产品。
Erenumab 医药交易
2021年3月,诺华宣布DRAGON III期研究取得积极结果达到主要终点。这是一项随机双盲、多中心、安慰剂对照的III期临床试验,旨在评估Erenumab预防性治疗成人慢性偏头痛的有效性和安全性。该研究共入组557例患者,以亚洲为中心、中国人群为主。
结果表明,Erenumab 70 mg组在12周双盲治疗期最后4周相比基线降低每月偏头痛天数(MMD)疗效终点(主要终点)上显著优于安慰剂组。此外,Erenumab70mg组每月偏头痛天数相比基线减少50%以上的应答率显著高于安慰剂组。同时,Erenumab的安全耐受性特征与安慰剂组相似,未发现新的安全性问题。
DRAGON 试验结果

辉瑞 · Rimegepant
辉瑞在2021年11月以总额12.4亿美元与Biohaven 达成合作,获得了两款CGRP拮抗剂的权益,包括口服偏头痛药物Rimegepant(Nurtec® ODT)在美国以外的权益。
Rimegepant通过可逆地阻断CGRP受体来靶向偏头痛的关键成分,从而抑制导致偏头痛发作的生物级联反应。
2020年2月,该药在美国首次获批,2021年5月又获批扩展适应症,是首个同时获批用于成人偏头痛急性和预防性治疗的口服CGRP受体拮抗剂。此后,
2022年4月在欧洲获批上市。
2022年2月,Biohaven和辉瑞共同宣布Rimegepant用于治疗急性偏头痛的3期临床试验达到了有效性和安全性的共同主要终点。这是Rimegepant用于急性偏头痛治疗的第4个积极3期临床研究,同时也是首个在亚太地区进行的研究。
该研究是一项随机、多中心3期临床研究(登记号:NCT04574362),共纳入1431名成人患者,其中近80%的受试者入组来自中国,其余约20%在韩国。
研究结果显示,在单次口服给药2小时后达到了无疼痛 (p<0.0001) 和最烦人的偏头痛相关症状 (MBS,包括恶心、畏声或畏光) 的共同主要终点 (p<0.0001) 。在该研究中,单次口服75 mg的Rimegepant可显著缓解偏头痛症状,并在2小时后恢复正常功能,并为许多患者提供持续长达48小时的持续疗效。
安全性方面,Rimegepant在研究参与者中显示出良好的安全性和耐受性,这与美国先前的临床试验结果一致。
NCT04574362 临床试验结果

礼来 · Galcanezumab
2022年7月,礼来CGRP单抗Galcanezumab注射液在国内的上市申请获受理(受理号:JXSS2200028)。
Galcanezumab(商品名:Emgality)最早于2018年9月获FDA批准上市,用于预防性治疗成人偏头痛。此后,于2019年6月,新适应症再获FDA批准,用于治疗成人发作性丛集性头痛(ECH)。
2021年9月,礼来中国宣布,Galcanezumab用于预防性治疗成人发作性偏头痛的全球多中心III期CGAX研究取得积极主要研究结果。CGAX研究在主要研究终点和全部4个关键次要终点与既往完成的所有Galcanezumab全球研究结果高度一致。
在主要研究终点每月头痛天数 (MHD) 上,CGAX研究显示Galcanezumab治疗组显著优于安慰剂组。在四个评估偏头痛对功能影响的关键次要终点,MSQ评分(生活质量评分)、50%缓解率(头痛天数较基线水平改善达到50%或以上的患者比例)、75%缓解率和100%缓解率上,CGAX数据同样显示治疗组优于安慰剂组,与全球已完成的主要研究结果一致。
CGAX研究结果显示Galcanezumab的安全性良好,不良事件的严重程度多为轻度到中度,未发生严重不良事件或死亡事件,安全性结果与已知Galcanezumab全球安全性特征一致。
除以上提及的10款新药外,李氏大药厂首克注利单抗、科伦药业泰特利单抗、罗氏长效C5补体抑制剂珂罗利单抗以及罗氏JAK抑制剂利特昔替尼等均有望今年下半年获批上市。
END来源 | Insight数据库



